技術セミナー・研修・出版・書籍・通信教育・eラーニング・講師派遣の テックセミナー ジェーピー
医薬品メーカ20社〔米国特許版〕 技術開発実態分析調査報告書
特許情報分析(パテントマップ)から見た
医薬品メーカ20社〔米国特許版〕 技術開発実態分析調査報告書
~注目技術別動向予測シリーズ~

概要
本調査報告書は、「医薬品メーカ20社〔米国特許版〕」に関するパテントマップ、パテントチャートを作成し、技術開発動向、最近の注目技術など具体的なデータを提供しております。
医薬品メーカ20社〔米国特許版〕 技術開発実態分析調査報告書のCD-ROM版 もご用意しております。
ご案内
1. 調査目的
従来は低分子化合物が医薬品の中心であったが、近年、バイオテクノロジーを創薬に応用したバイオ医薬品が伸長しており、 その比率も高まっている。その医薬品に関して、W.W.売上高上位20社の所有米国特許件数、発明者、特許分類、キーワード などを用い、医薬業界における各社の位置付けや、比較などを、時系列推移、技術分布、技術相関など様々な観点から分析 したパテントマップを作成し、- (1). 各社がどのような技術を保有しているか、
- (2). 各社の技術開発動向はどのように推移しているか、
- (3). 各社の技術で最近注目すべきものは何なのか、
- (4). 各社と共同出願人との連携状況どのようになっているか、
等を明確にして、各社の知財の現状につき具体的なデータを提供し、今後の開発の指針決定に役立てようとするものである。
2. 特許情報の収集方法
本調査報告書は、W.W.医薬品売上高上位20社に関する米国特許(1994年~2013年登録、2012年~2013年公開)について検索・収集した。また、報告書作成には、パテントマップ作成支援ソフト「パテントマップEXZ」(インパテック(株)製)を使用した。 特許情報公報の総数は33,359件 である。3. 報告書の構成
本報告書は、次の3章から構成されている。- 1. パテントマップ編
- A. 技術開発成果(特許取得の推移)
- B. 技術開発リソース(発明者の活動状況)
- C. 技術開発分野(特許分類・キーワード分析)
- D. バイオ医薬・種類別分析
- E. 20社個別分析
- F. 直近2年間の20社の動向分析(2012年1月~2013年12月)
- 2. パテントチャート編
- G. チャート分析
- 3. 総括コメント
4. 本報告書の特徴
- 医薬に関連する技術動向が分かりやすく把握できる
- パテントマップおよびパテントチャートで視覚的に理解しやすい
パテントマップ実例、および本文中の実際のページ例
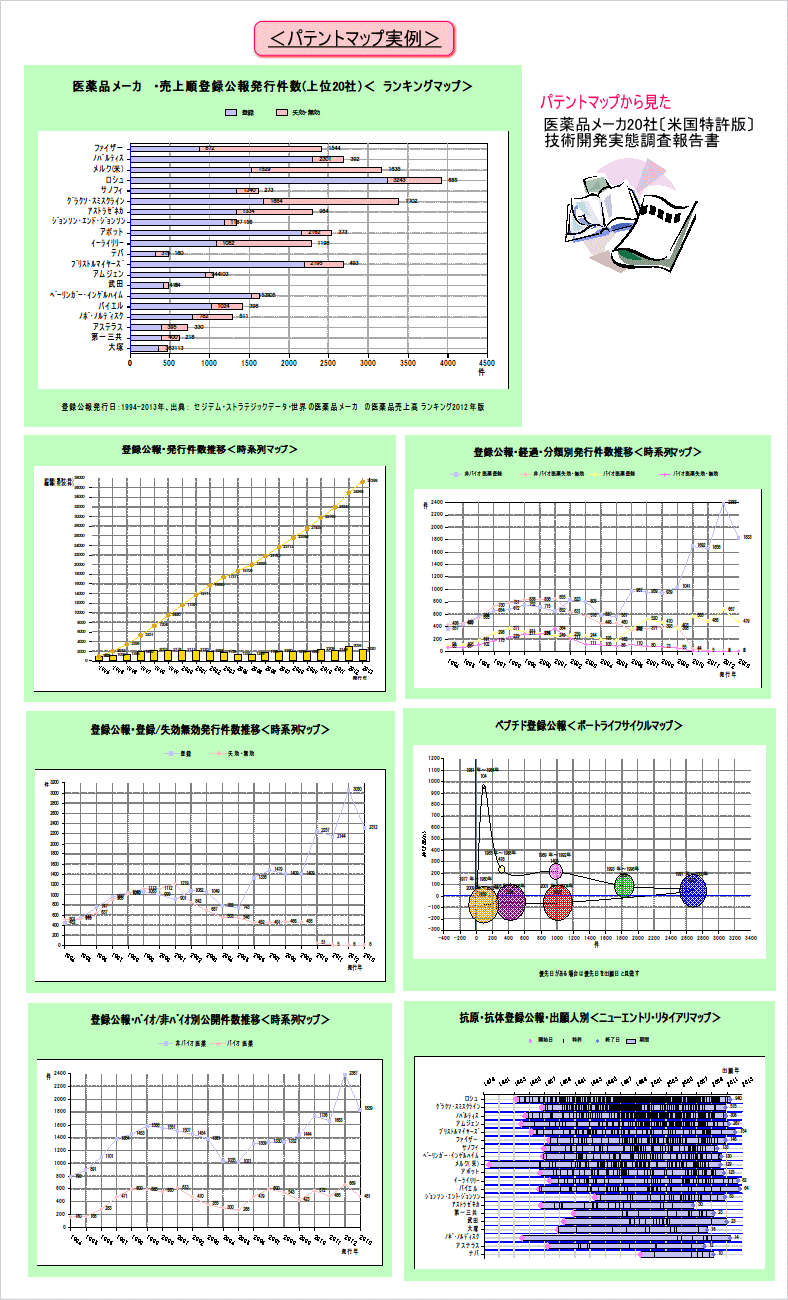
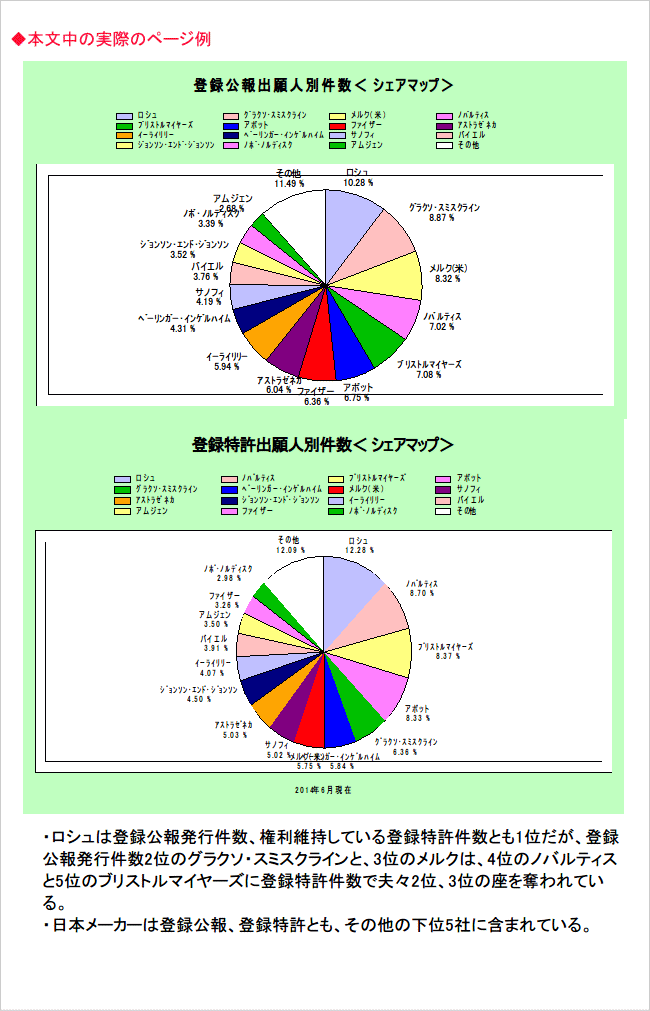
目次
はじめに
調査分析結果
1. パテントマップ編
- A. 技術開発成果(特許取得の推移)
- A-1. 登録公報発行件数の推移(年次と累計)
- A-2. 登録公報出願件数の推移(年次と累計)
- A-3. 登録公報・登録/失効・無効発行件数推移/出願件数推移(年次と累計)
- A-4. 登録公報 バイオ/非バイオ別発行・出願件数の推移(年次)
- A-5. 登録公報 経過分類別発行・出願件数の推移(年次)
- A-6. 登録公報 売上順出願人別件数、および審査・権利状況別件数
- A-7. 登録公報 出願人別件数、および医薬分類別件数
- A-8. 登録特許 出願人別件数、および医薬分類別件数
- A-9. 登録公報 出願人別発行件数の推移比較(年次)
- A-10. 登録公報 出願人別出願件数の推移(年次)
- A-11. 登録公報および登録特許 出願人別件数
- A-12. バイオ医薬 登録公報・登録特許出願人別件数
- A-13. 非バイオ医薬 登録公報・登録特許出願人別件数
- B. 技術開発リソース(発明者の活動状況)
- B-1. 発明者数の推移(年次と累計)
- B-2. 新規発明者数の推移(年次と累計)
- B-3. バイオ/非バイオ別 発明者および新規発明者数の推移(年次)
- B-4. 発明者別出願件数ランキング(上位50)
- B-5. 発明者別入退場状況(上位50)
- B-6. 早期参入発明者別入退場状況(上位50)
- B-7. 早期参入発明者別入退場状況(5件以上)
- B-8. 最近参入発明者別入退場状況
- B-9. 最近参入発明者別入退場状況(10件以上)
- C. 技術開発分野
- C-1. 登録公報 USPC/CPC付与件数推移
- C-2. 登録公報 新規USPC/CPC付与件数推移
- C-3. USPC分類別件数(上位50)
- C-4. USPC分類別件数(51-100位) 表-1-1..USPC分類(424-514/255.05) 表-1-2..USPC分類(514/256-530/402) 表-1-3..USPC分類(536-546/268.1)
- C-5. USPCメインクラス別件数(上位20)
- C-6. 非バイオ医薬USPC分類別件数(上位50)
- C-7. バイオ医薬USPC分類別件数(上位50)
- C-8. USPCメインクラス514・サブクラス別件数(上位50)
- C-9. USPCメインクラス435・サブクラス別件数(上位50)
- C-10. USPCメインクラス530・サブクラス別件数(上位50)
- C-11. USPCメインクラス424・サブクラス別件数(上位50)
- C-12. USPCメインクラス536・サブクラス別件数(上位50)
- C-13. USPCメインクラス800・サブクラス別件数(上位50)
- C-14. CPC分類サブグループ別件数(上位50)
- C-15. CPC分類サブグループ別件数(51-100位) 表-2-1.CPC分類(A01K2217/00 -C07D213/82) 表-2-2.CPC分類(C07D231/00-C07D417/14) 表-2-3.CPC分類(C07D453/00 -G01N2500/00)
- C-16. CPC分類メイングループ別件数(上位50)
- C-17. CPC分類サブグループ別件数(2階層まで、上位50)
- C-18. 非バイオ医薬CPC分類別件数(上位50)
- C-19. バイオ医薬CPC分類別件数(上位50)
- C-20. CPC分類:C07Kメイングループ別件数
- C-21. CPC分類:C12Nメイングループ別件数
- C-22. CPC分類:C12Pメイングループ別件数
- C-23. CPC分類:A61Kメイングループ別件数
- C-24. CPC分類:Y10Sサブグループ別件数
- C-25. バイオ医薬 登録/失効・無効 CPC件数比較
- C-26. 非バイオ医薬 登録/失効・無効 CPC件数比較
- C-27. バイオ医薬キーワード別件数(上位50)
- C-28. 非バイオ医薬キーワード別件数(上位50)
- D. バイオ医薬・種類別分析
- D-1. バイオ医薬種類別件数
- D-2. ペプチド件数推移
- D-3. ペプチド出願人別件数
- D-4. ペプチド・研究開発ライフサイクル/出願人別入退場
- D-5. ペプチド 出願人/新規出願人*登録公報件数
- D-6. ペプチド 発明者/新規発明者*登録公報件数
- D-7. ペプチドCPC別・成長率(上位20)/増減数(上位15)
- D-8. 抗原・抗体件数推移
- D-9. 抗原・抗体出願人別件数
- D-10. 抗原・抗体研究開発ライフサイクル/出願人別入退場
- D-11. 抗原・抗体 出願人/新規出願人*登録公報件数
- D-12. 抗原・抗体 発明者/新規発明者*登録公報件数
- D-13. 抗原・抗体CPC別・成長率(上位20)/増減数(上位15)
- D-14. 遺伝子件数推移
- D-15. 遺伝子 出願人別件数
- D-16. 遺伝子 研究開発ライフサイクル/出願人別入退場
- D-17. 遺伝子 出願人/新規出願人*登録公報件数
- D-18. 遺伝子 発明者/新規発明者*登録公報件数
- D-19. 遺伝子 CPC別・成長率(上位20)/増減数(上位15)
- D-20. 核酸件数推移
- D-21. 核酸出願人別件数
- D-22. 核酸 研究開発ライフサイクル/出願人別入退場
- D-23. 核酸 出願人/新規出願人*登録公報件数
- D-24. 核酸 発明者/新規発明者*登録公報件数
- D-25. 核酸 CPC別・成長率(上位20)/増減数(上位15)
- D-26. バイオ医薬分類付与(CPC)相関件数
- D-27. バイオ医薬出願人別分類件数
- D-28. ペプチド出願人別件数
- D-29. 抗原・抗体出願人別件数
- D-30. 遺伝子出願人別件数
- D-31. 核酸出願人別件数
- D-32. バイオ医薬・出願人別入退場
- E. 出願人別分析
- E-1. ロシュ
- E-1-1. ロシュ登録公報・発行件数推移、発行年別件数
- E-1-2. ロシュ登録公報・出願件数推移(年次、累計)、出願年別件数
- E-1-3. ロシュ登録公報件数、バイオ登録公報件数
- E-1-4. ロシュ・バイオ登録公報発行件数推移、出願件数推移
- E-1-5. ロシュ発明者別件数、入退場(上位20)
- E-1-6. ロシュ・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-1-7. ロシュ遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-1-8. ロシュ登録公報・共同出願人件数(上位30)
- E-2. グラクソ・スミスクライン
- E-2-1. グラクソ・スミスクライン登録公報・発行件数推移、発行年別件数
- E-2-2. グラクソ・スミスクライン登録公報・出願件数推移(年次、累計)、出願年別件数
- E-2-3. グラクソ・スミスクライン登録公報件数、バイオ登録公報件数
- E-2-4. グラクソ・スミスクライン バイオ登録公報発行件数推移、出願件数推移
- E-2-5. グラクソ・スミスクライン発明者別件数、入退場(上位20)
- E-2-6. グラクソ・スミスクライン/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-2-7. グラクソ・スミスクライン遺伝子/ペプチド発明者別件数、遺伝子/ 抗原・抗体発明者別件数
- E-2-8. グラクソ・スミスクライン登録公報・共同出願人件数(上位30)
- E-3. メルク
- E-3-1. メルク登録公報・発行件数推移、発行年別件数
- E-3-2. メルク登録公報・出願件数推移(年次、累計)、出願年別件数
- E-3-3. メルク登録公報件数、バイオ登録公報件数
- E-3-4. メルク・バイオ登録公報発行件数推移、出願件数推移
- E-3-5. メルク発明者別件数、入退場(上位20)
- E-3-6. メルク・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-3-7. メルク遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-3-8. メルク登録公報・共同出願人件数(上位30)
- E-4. ノバルティス
- E-4-1. ノバルティス登録公報・発行件数推移、発行年別件数
- E-4-2. ノバルティス登録公報・出願件数推移(年次、累計)、出願年別件数
- E-4-3. ノバルティス登録公報件数、バイオ登録公報件数
- E-4-4. ノバルティス・バイオ登録公報発行件数推移、出願件数推移
- E-4-5. ノバルティス発明者別件数、入退場(上位20)
- E-4-6. ノバルティス・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-4-7. ノバルティス遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-4-8. ノバルティス登録公報・共同出願人件数(上位30)
- E-5. ブリストルマイヤーズ
- E-5-1. ブリストルマイヤーズ登録公報・発行件数推移、発行年別件数
- E-5-2. ブリストルマイヤーズ登録公報・出願件数推移(年次、累計)、出願年別件数
- E-5-3. ブリストルマイヤーズ登録公報件数、バイオ登録公報件数
- E-5-4. ブリストルマイヤーズ・バイオ登録公報発行件数推移、出願件数推移
- E-5-5. ブリストルマイヤーズ発明者別件数、入退場(上位20)
- E-5-6. ブリストルマイヤーズ ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-5-7. ブリストルマイヤーズ 遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-5-8. ブリストルマイヤーズ登録公報・共同出願人件数(上位30)
- E-6. アボット
- E-6-1. アボット登録公報・発行件数推移、発行年別件数
- E-6-2. アボット登録公報・出願件数推移(年次、累計)、出願年別件数
- E-6-3. アボット登録公報件数、バイオ登録公報件数
- E-6-4. アボット・バイオ登録公報発行件数推移、出願件数推移
- E-6-5. アボット発明者別件数、入退場(上位20)
- E-6-6. アボット・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-6-7. アボット遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-6-8. アボット登録公報・共同出願人件数(上位30)
- E-7. ファイザー
- E-7-1. ファイザー登録公報・発行件数推移、発行年別件数
- E-7-2. ファイザー登録公報・出願件数推移(年次、累計)、出願年別件数
- E-7-3. ファイザー登録公報件数、バイオ登録公報件数
- E-7-4. ファイザー・バイオ登録公報発行件数推移、出願件数推移
- E-7-5. ファイザー発明者別件数、入退場(上位20)
- E-7-6. ファイザー・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-7-7. ファイザー遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-7-8. ファイザー登録公報・共同出願人件数(上位30)
- E-8. アステラス
- E-8-1. アステラス登録公報・発行件数推移、発行年別件数
- E-8-2. アステラス登録公報・出願件数推移(年次、累計)、出願年別件数
- E-8-3. アステラス登録公報件数、バイオ登録公報件数
- E-8-4. アステラス・バイオ登録公報発行件数推移、出願件数推移
- E-8-5. アステラス発明者別件数、入退場(上位20)
- E-8-6. アステラス・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-8-7. アステラス遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-8-8. アステラス登録公報・共同出願人件数(上位30)
- E-9. 第一三共
- E-9-1. 第一三共登録公報・発行件数推移、発行年別件
- E-9-2. 第一三共登録公報・出願件数推移(年次、累計)、出願年別件数
- E-9-3. 第一三共登録公報件数、バイオ登録公報件数
- E-9-4. 第一三共・バイオ登録公報発行件数推移、出願件数推移
- E-9-5. 第一三共発明者別件数、入退場(上位20)
- E-9-6. 第一三共・ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-9-7. 第一三共遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-9-8. 第一三共登録公報・共同出願人件数(上位30)
- E-10. 大塚
- E-10-1. 大塚 登録公報・発行件数推移、発行年別件数
- E-10-2. 大塚 登録公報・出願件数推移(年次、累計)、出願年別件数
- E-10-3. 大塚 登録公報件数、バイオ登録公報件数
- E-10-4. 大塚・バイオ登録公報発行件数推移、出願件数推移
- E-10-5. 大塚 発明者別件数、入退場(上位20)
- E-10-6. 大塚 ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-10-7. 大塚 遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-10-8. 大塚 登録公報・共同出願人件数(上位30)
- E-11. 武田
- E-11-1. 武田 登録公報・発行件数推移、発行年別件数
- E-11-2. 武田 登録公報・出願件数推移(年次、累計)、出願年別件数
- E-11-3. 武田 登録公報件数、バイオ登録公報件数
- E-11-4. 武田 バイオ登録公報発行件数推移、出願件数推移
- E-11-5. 武田 発明者別件数、入退場(上位20)
- E-11-6. 武田 ペプチド/抗原・抗体発明者別件数、抗原・抗体発明者別件数
- E-11-7. 武田 遺伝子/ペプチド発明者別件数、遺伝子/抗原・抗体発明者別件数
- E-11-8. 武田 登録公報・共同出願人件数(上位30)
- E-1. ロシュ
- F. 最近2年間の公開公報の動向分析
- F-1. 売上順最近2年間公開公報件数、件数順最近2年間公開公報件数
- F-2. 最近2年間公開公報・医薬分類別件数、バイオ医薬分類別件数
- F-3. 最近2年間公開、抗原・抗体件数、ペプチド件数
- F-4. 最近2年間公開・遺伝子件数、核酸件数
- F-5. 最近2年間公開・分類別出願件数推移、バイオ分類別出願件数推移
2. パテントチャート編
- G. チャート分析
- G-1. イーライリリー・第一三共:バイオ最近2年間公開出願年別時系列チャート
- G-2. イーライリリー・第一三共:バイオ最近2年間公開マトリクスチャート分析
- G-3. アステラス・バイオ登録特許の引用・被引用特許(フロー型)
- G-4. 第一三共・バイオ登録特許の引用・被引用特許(ネットワーク型)
3. 総括コメント
参考資料
- 資料1 : 出願人統合リスト
- 資料2 : 出願人グループ化リスト
出版社
お支払い方法、返品の可否は、必ず注文前にご確認をお願いいたします。
体裁・ページ数
A4判 簡易製本 (Viewerソフトウェア、パテントマップ・チャート添付) 205ページ
ISBNコード
978-4-86483-390-5
発行年月
2014年11月
販売元
tech-seminar.jp
価格
62,727円 (税別) / 69,000円 (税込)
同時購入割引
書籍版・CD-ROM版 の同時購入で 99,000円(税込) (通常価格 138,000円 税込) でご購入いただけます。
これから開催される関連セミナー
| 開始日時 | 会場 | 開催方法 | |
|---|---|---|---|
| 2025/1/31 | データインテグリティ (DI) における各手順書への落とし込み・作成と記載レベル | オンライン | |
| 2025/1/31 | 遺伝子治療用製品・細胞医薬品・ウイルスベクターコース (Bコース:非臨床安全性評価・臨床開発編) | オンライン | |
| 2025/1/31 | GMP工場における設備・機器の維持管理 (保守点検) と設備バリデーションの実際 | オンライン | |
| 2025/1/31 | オーファンドラッグ開発における情報収集ノウハウと疾患選択基準 | オンライン | |
| 2025/2/3 | 成功例・失敗例を踏まえた適切な医薬品売上予測とデータ収集法 | オンライン | |
| 2025/2/3 | FDA査察対応セミナー 入門編 | オンライン | |
| 2025/2/4 | 洗浄バリデーションにおけるリスク評価と残留許容値設定/運用 | オンライン | |
| 2025/2/4 | 体外診断用医薬品の保険申請戦略と申請書の書き方 | オンライン | |
| 2025/2/4 | 医薬品企業における英文契約書読み方基礎講座 | オンライン | |
| 2025/2/5 | 基礎から学ぶ分析法バリデーション | オンライン | |
| 2025/2/5 | バリデーション入門講座 | オンライン | |
| 2025/2/5 | 高効率を目的としたGVPにおける情報収集と自己点検、教育訓練 | オンライン | |
| 2025/2/5 | 無菌医薬品の滅菌選択順位の考え方と無菌性保証における無菌試験の限界、並びにパラメトリックリリースの推奨 | オンライン | |
| 2025/2/5 | GMP省令が要求するQAの逸脱の防止対策とCAPA/変更管理 | オンライン | |
| 2025/2/5 | 医薬品CMC開発における治験薬GMP対応 | オンライン | |
| 2025/2/5 | NMPAをはじめとする中国医薬品開発の実施/申請プロセスおよび要求される法規と医療保険政策情勢 | オンライン | |
| 2025/2/5 | LBPs (Live Biotherapeutic Products) におけるCMC開発 | オンライン | |
| 2025/2/5 | 薬機法の実務を考慮した医薬品特許戦略の新たな視点 | オンライン | |
| 2025/2/6 | 治験薬GMPにおける品質システム運用と記録の残し方 | オンライン | |
| 2025/2/6 | インドネシアにおけるハラール認証BPJPHをふまえた医薬品・医療機器開発等の留意点とポイント | オンライン |
関連する出版物
| 発行年月 | |
|---|---|
| 2020/3/30 | 当局要求をふまえたデータインテグリティ手順書作成の要点 |
| 2020/3/24 | リアルワールドデータの使用目的に応じた解析手法 - 各データベースの選択と組み合わせ - |
| 2020/2/27 | 海外データ (試験施設) /海外導入品の信頼性基準適用と効率的なデータ利用・CTD申請 |
| 2020/1/30 | 凍結乾燥の最適な条件設定による品質の安定化 - ラボ機と生産機の性能の違いを反映させたスケールアップ - |
| 2019/8/1 | データインテグリティ規程・手順書 |
| 2019/6/27 | EU GVP Module I /ISO9001要求をふまえたQuality Management System の実装と運用 |
| 2019/6/27 | FDAが要求するCAPA導入の留意点 |
| 2019/5/31 | 医薬品モダリティの特許戦略と技術開発動向 |
| 2019/4/24 | 洗浄バリデーション実施ノウハウと実務Q&A集 |
| 2018/11/30 | 希少疾患用医薬品の適応拡大と事業性評価 |
| 2018/10/30 | 高薬理活性医薬品封じ込めQ&A集 Part2 |
| 2018/9/28 | 腸内細菌叢を標的にした医薬品と保健機能食品の開発 |
| 2018/8/31 | がん治療で起こる副作用・合併症の治療法と薬剤開発 |
| 2018/7/31 | 医薬品・医療機器・再生医療開発におけるオープンイノベーションの取り組み 事例集 |
| 2018/6/29 | 医薬品グローバル開発に必要な英語実務集 |
| 2018/5/30 | GVP Module改訂をふまえたEU Pharmacovigilance規制の実装 |
| 2018/5/18 | 創薬のための細胞利用技術の最新動向と市場 |
| 2018/4/25 | 統計学的アプローチを活用した分析法バリデーションの評価及び妥当性 |
| 2018/1/30 | バイオ医薬品のCTD-Q作成 - 妥当性の根拠とまとめ方 - |
| 2017/9/29 | 疾患・病態検査・診断法の開発 |